
已知:无水乙酸钠在碱石灰作用下发生反应:
回答下列问题:
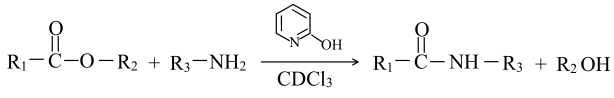 , 通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小解释原因。
, 通常用酯基和氨基生成酰胺基,不用羧基和氨基直接反应,结合成键元素间电负性差值大小解释原因。元素 | H | C | O |
电负性 | 2.1 | 2.5 | 3.5 |
i.含有3个六元环,其中1个是苯环;
ii.含有![]() 结构,不含
结构,不含键;
iii.含有4种不同化学环境的氢原子。


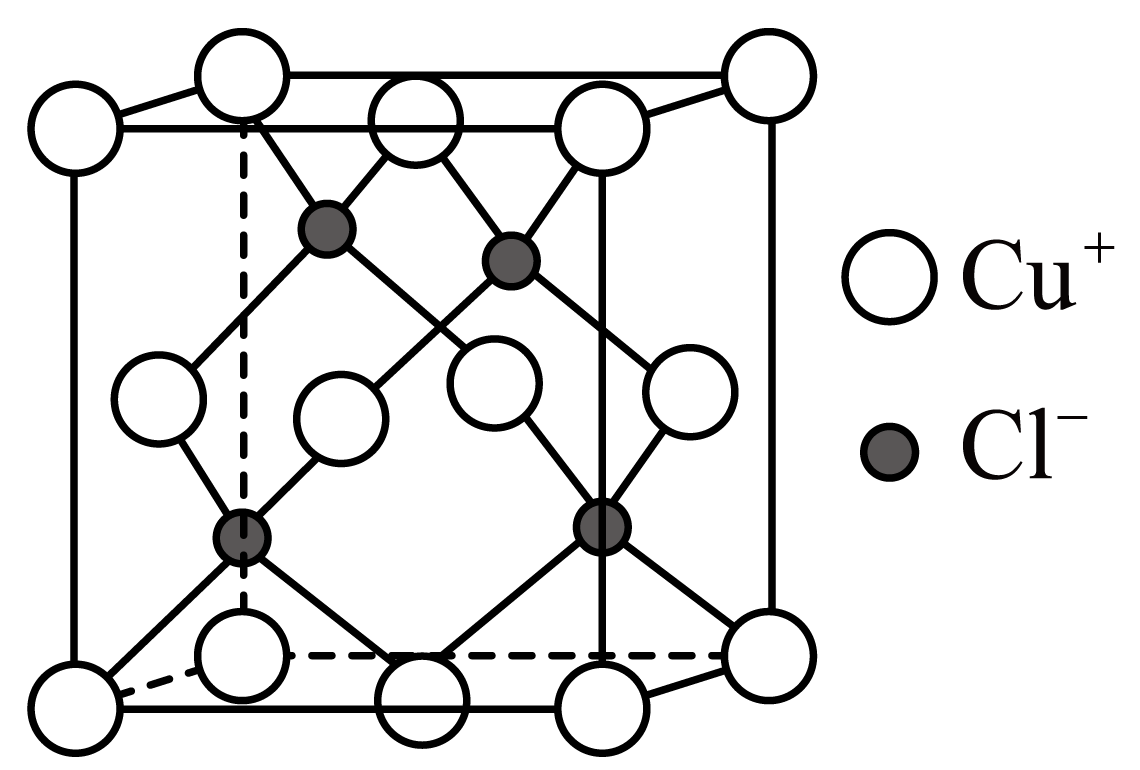
已知:i.水溶液中不存在碳酸铜,碳酸铜遇水立即水解为碱式碳酸铜和氢氧化铜。
ii.室温时,的溶度积常数
。
I.
Ⅱ.
Ⅲ.。
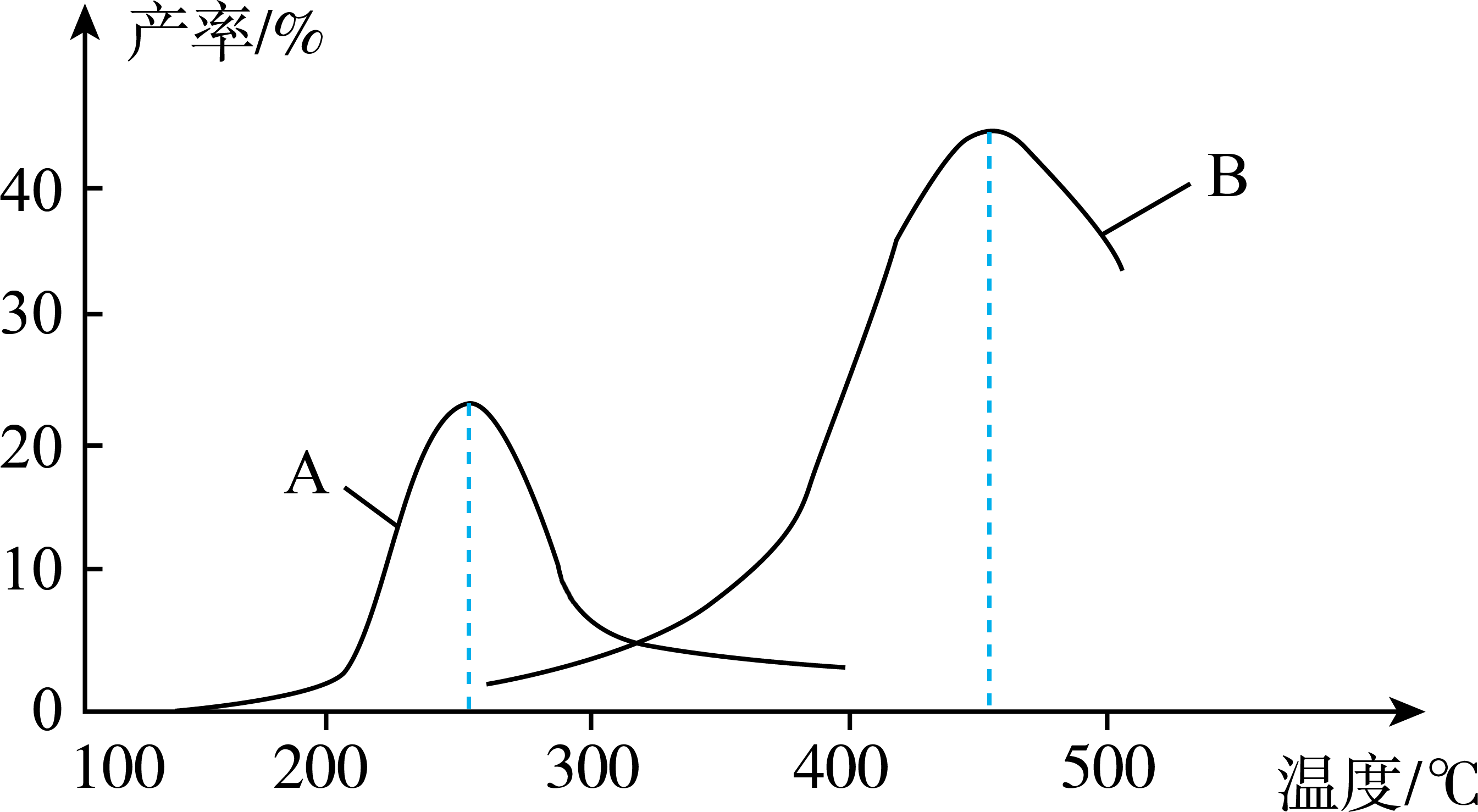
①下列说法正确的是(填序号)。
A.使用催化剂B的最佳温度约为250℃
B.相同条件下,改变压强会影响的产率
C.催化剂不仅能改变反应速率,还能改变平衡时![]() 产率
产率
D.两种催化剂均能降低反应的活化能,但不能改变的数值
②在催化剂A作用下,温度低于200℃时,的产率随温度升高变化不大,主要原因是。
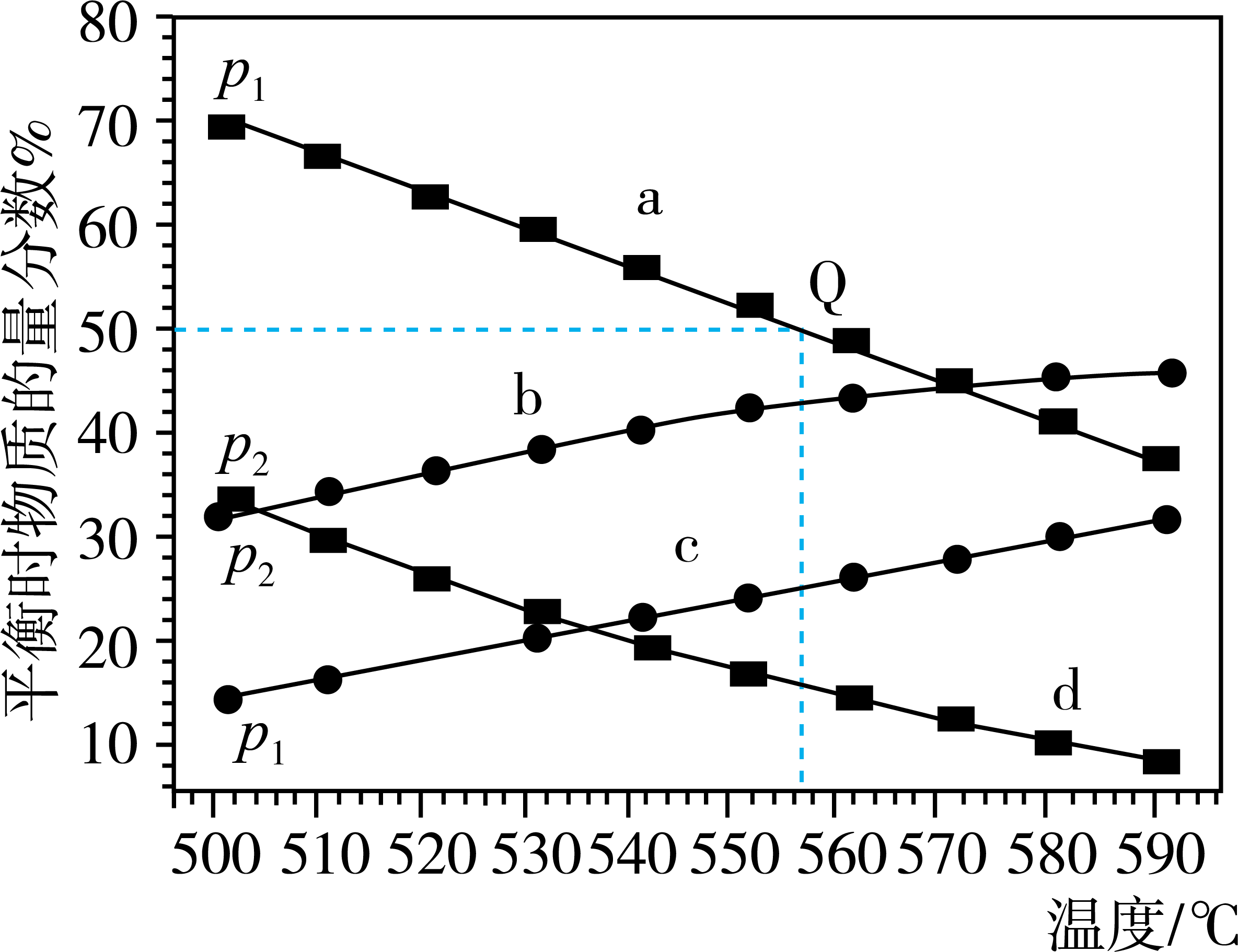
①b、c代表(填“丙烷”或“丙烯”),(填“大于”“小于”或“等于”)
②起始时充入一定量丙烷,在恒压条件下发生反应,Q点对应温度下丙烷的转化率为(用分数表示),该反应的平衡常数
=
(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
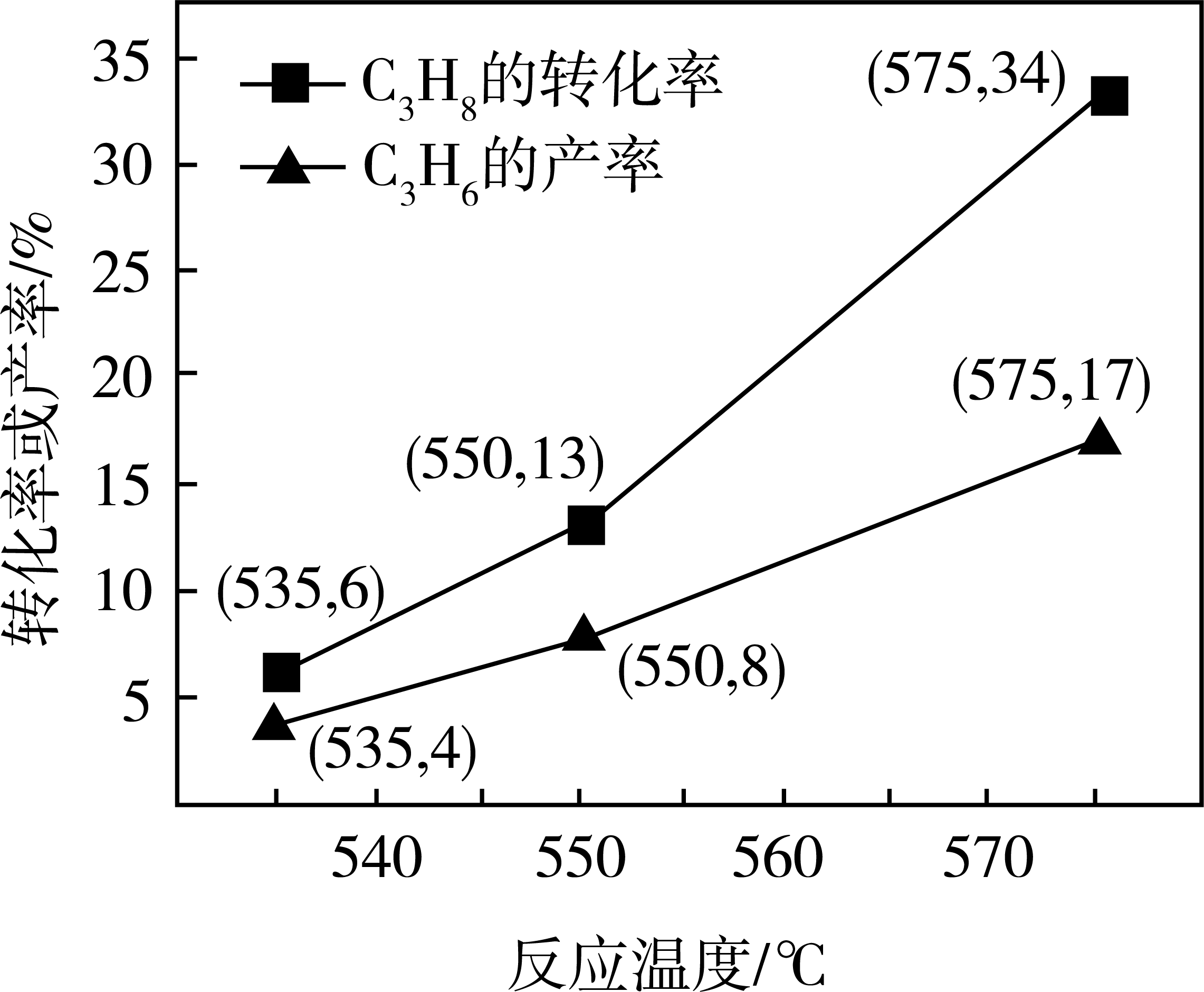
①550℃时,的选择性为%(
的选择性=
, 计算结果精确到0.1)。
②基于上述研究结果,能提高的选择性的措施是。