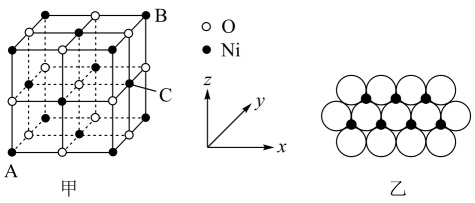
 可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( )
可从中药材当归和白芷中提取得到,能提高人体免疫力。有关该化合物,下列叙述错误的是( )
 )是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
)是重要的有机化工原料,广泛用于农药、橡胶、塑料等生产。回答下列问题:
A.通入惰性气体 B.提高温度 C.增加环戊烯浓度 D.增加碘浓度

![]()
①B的化学式;D的颜色。
②实验室中常用A和另一种固体制备B,写出相应的化学方程式。
①图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择(填字母标号)。
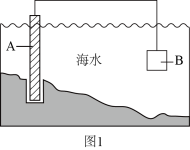
a.碳棒 b.锌板 c.铜板
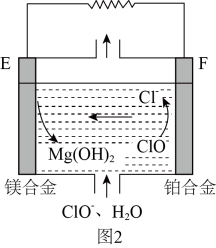
②镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的(填“正”或“负”)极。F电极上的电极反应式为。
 )可与氨反应,转化为吡咯(
)可与氨反应,转化为吡咯(